前言:固定化金属亲和层析(IMAC)是一种常用的蛋白纯化方法,尤其针对融合了多组氨酸标签的重组蛋白。通过螯合配体固定在基质上的过渡金属离子与多组氨酸标签相互作用,有效地从样品中分离融合蛋白。硝基三乙酸(NTA)和亚氨基二乙酸(IDA)是市场上常用的两种配体,下面我们详细描述了这两种配体的差异和优缺点。
1975年开始,固定化金属亲和层析法(IMAC)通过不断地改进,已被广泛用于蛋白纯化。过渡金属离子通过配体固定在基质上,与融合到肽的C端或N端的多组氨酸标签(由3 - 10个组氨酸组成)的咪唑环相互作用。这种相互作用有效地将蛋白从溶液中分离出来,然后通过咪唑梯度洗脱、改变pH值或金属螯合作用,将蛋白从金属离子上洗脱下来。
IMAC最初是为对金属离子有内在亲和力的天然蛋白开发的,现在的应用已经扩大到磷酸化蛋白、抗体和带有多组氨酸标签的蛋白。多组氨酸标签的优点是尺寸小和低免疫原性,通常不会干扰蛋白的性能。三价和四价离子通常用于纯化磷酸蛋白,而二价离子如Ni2+、Cu2+和Zn2+则用于带有His标签的重组蛋白。IMAC成本较低,且可在多种条件下使用。例如,咪唑-金属离子的相互作用可以在原生和变性条件下进行,也可以在氧化或还原条件下进行。IMAC兼容多种化学物质。由于其亲和力高,特异性强的特性使得即使从粗裂解液中也能非常有效地纯化蛋白。
配体的配位数会影响洗脱的蛋白产量和纯度
目前最常用的用于蛋白亲和纯化的IMAC树脂是IDA和NTA。从结构上来看,IDA和NTA的不同之处在于NTA上存在一个额外的羧甲基。从化学角度来说,与IDA的三个价相比,NTA有四个价,因此额外的官能团使NTA成为更强的金属离子配位剂(图1)。
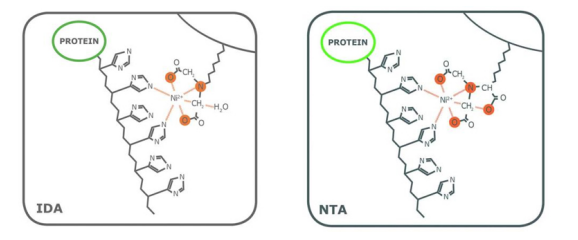
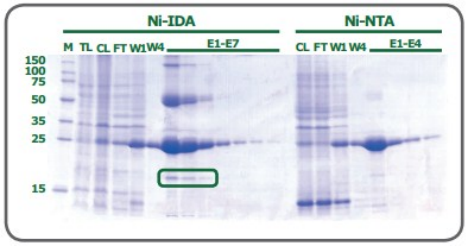
虽然这两种配体都有两个价位可以与组氨酸残基的咪唑环相互作用,但配位数对纯度有一定影响。作为一个三价配体(配位数为3),IDA上的金属离子较容易脱落,特别是在平衡和洗脱步骤中。基于NTA的树脂的洗脱部分也含有脱落的金属离子,但明显少于IDA中观察到的金属离子。另外,虽然有些变化是由被处理的蛋白的性质决定的,但与从NTA树脂中获得的蛋白相比,从IDA树脂中洗脱的His标签蛋白的纯度往往较低。例如图2为在大肠杆菌中表达并在PureCube Ni-IDA和PureCube Ni-NTA树脂上纯化的eGFP的SDS-PAGE结果。IDA树脂的前三个洗脱组分显示出除了目的条带外,还有另外的杂带。
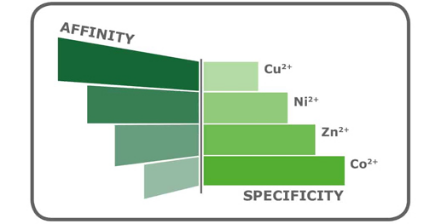
然而,IDA也有优势,用这种配体合成的树脂通常比较便宜。此外,与四价NTA相比,三价配体需要较低的咪唑浓度来洗脱蛋白。IDA与NTA相比是一种更小的分子,可以以更高的密度与基质偶联,从而获得更高的金属负载能力。一般来说,低负载密度能提高纯化纯度,但会导致目标蛋白产量降低,而高负载密度能提高产量,但具有较高的非特异性结合。通过将IDA或NTA的负载密度与不同金属离子的亲和力和特异性相结合(图3),可以优化特定蛋白的纯度和产量。
蛋白决定了配体和金属离子
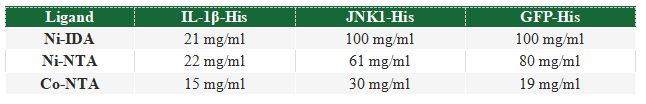
当被问及为什么使用一种配体而不是另一种配体来纯化His标签的蛋白时,大多数研究人员无法解释。探索不同的配体是有好处的,因为一个特定的IMAC树脂的结合能力非常依赖于所使用的金属离子和被纯化蛋白的性质。使用另一种配体金属组合可能会得到更好的纯化效果。例如,IDA通常比NTA具有更高的金属离子容量(每毫升PureCube IDA琼脂糖树脂>25 μmol Ni2+或Cu2+,每毫升PureCube NTA琼脂糖>15 μmol/ml)。从理论上讲,IDA为目标蛋白提供了更多的结合位点,从而产生更大的容量,如表1与JNK1和GFP的结合所示。然而,不同的蛋白结合能力不同,如白细胞介素-1β。另外一方面,将不同的金属离子与树脂耦合,会导致对带有His标签的蛋白出现不同的亲和力。钴具有较高的结合特异性,但亲和力较低(图3),因此钴树脂的产量较低(表1)。镍以较高的亲和力换取特异性,这就是其产量较高的原因。我们可以探索不同的金属离子和配体组合来优化His标签蛋白的纯化效果。
样品中的成分会影响配体的选择
目标样品中某些特定化合物的存在会影响IDA和NTA树脂的结合能力。DTT是一种还原剂,用于制备SDS-PAGE时稳定含有游离巯基的蛋白并破坏二硫键。DTT会减少IMAC树脂的金属离子,使树脂的颜色变为棕色。在一项比较研究中,将不同浓度的DTT加入到PureCube Ni-IDA琼脂糖和PureCube Ni-NTA琼脂糖中。两种树脂的结合能力呈现非线性下降,随着DTT浓度的增加,Ni-NTA的平均衰减率为8.0%,而Ni-IDA的平均衰减率为11.1%。在10mM DTT时,Ni-NTA和Ni-IDA的结合能力的总体下降率分别为22%和30%(图4A)。
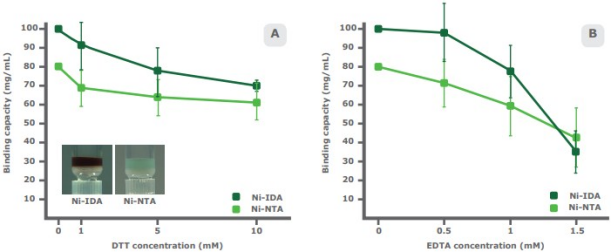
EDTA对结合能力的影响更显著。这种六价螯合剂存在于许多缓冲液和金属离子螯合物中。研究表明,在较高的EDTA浓度下,Ni-NTA比Ni-IDA更稳定。Ni-NTA的结合能力非线性地整体下降了46%,1mM EDTA之后的衰减略快。到1mM EDTA时,Ni-IDA的结合能力的衰减与Ni-NTA相似。此后,结合能力急剧下降(总体下降65%;图4B)。 选择是用NTA还是IDA进行蛋白纯化时,可以考虑以下问题:
你的目标蛋白需要多高的纯度?
你需要获得多少目标蛋白?
你的样品是否含有DTT或EDTA?
你的预算是多少?
你的蛋白表达量预计是多少?
如果你的首选是高产量而非纯度,那么IDA的树脂可能是正确的选择。因其价格较低,同时较为耐用,容易再生和重新装柱。为了减少非特异性结合,可以尝试使用替代的金属离子,如锌和钴。如果对蛋白纯度要求较高(例如,用于后续的结晶),那么NTA树脂是最理想的选择。通过在树脂中加入具有高度特异性结合的金属离子(如钴)可以进一步提高特异性。基于NTA树脂的另一个优点是它们在DTT和EDTA等试剂的存在下比Ni-IDA更稳定。树脂的结构也是一个决定性因素,基质和纯化过程也会影响最终纯度。此外,在给定的蛋白总量下使用过多的树脂会导致结合点被暴露出来,从而出现杂质。
IDA树脂价格较低
NTA树脂能得到纯度更高的蛋白
NTA树脂的金属离子脱落量明显较少
改变金属离子可以调整树脂的结合特异性。Co2+的特异性最高,然后是Ni2+和Zn2+,Cu2+最低。
NTA树脂对还原剂和螯合剂有很强的抵抗力
1.Block, H., et al. 2009. Immobilized-metal affinity chromatography (IMAC): a review. In: Richard, B.R. and Deutscher, M.P., eds. Methods Enymol 463: 439–473.
2.Young, C.L., Britton, Z.T., and Robinson, A.S. 2012. Recombinant protein expression and purification: a comprehensive review of affinity tags and microbial applications. Biotechnol J 7: 620–634.
3.Porath, J., et al. 1975. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature 258: 598–599.
4.Hochuli, E., Döbeli, H., and Schacher, A. 1987. New metal chelate adsorbent for proteins and peptides containing neighbouring histidine residues. J Chromatogr 411: 177–184.




















