EED蛋白最初被发现通过识别组蛋白修饰调控PRC2活性以维持基因沉默,作为PRC2复合体的组装支架之一,与乳腺癌、结直肠癌、前列腺癌、b细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)等多种癌症都存在关联,已经成为表观遗传药物研发的重要靶点。
青云瑞晶完成了EED和小分子共晶的结构解析,针对该靶点积累了丰富的蛋白表达纯化和抑制剂的共晶结构解析的经验。基于这些实验条件和库存蛋白,将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
蛋白表达和结构解析结果详见文末!
关于 EED
1.1 EED 蛋白的作用
胚胎外胚层发育蛋白(Embryonic Ectoderm Development,EED)最早在果蝇胚胎发育研究中被鉴定为多梳蛋白家族(Polycomb Group,PcG)的关键成员,后续研究发现其是多梳抑制复合体2(Polycomb Repressive Complex 2, PRC2)的核心亚基之一(图1)。
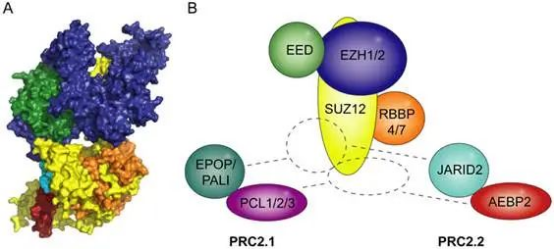
图1 PRC2复合体结构示意图[1]
PcG是一类在进化上高度保守的与生长发育相关的转录抑制因子,其作用机制主要是通过修饰组蛋白或改变染色质结构进而引起同源异型基因或发育调控基因的表达沉默。
PcG有多个家族成员,其中发挥转录抑制功能的主要有 PRC1和PRC2,两者由不同的催化和调节亚基组成。其中PRC2蛋白复合物具有甲基转移酶活性,可以催化组蛋白H3K27的二甲基化和三甲基化修饰反应(如组蛋白H3第27位赖氨酸进行三甲基化修饰,H3K27me3)(图2)。
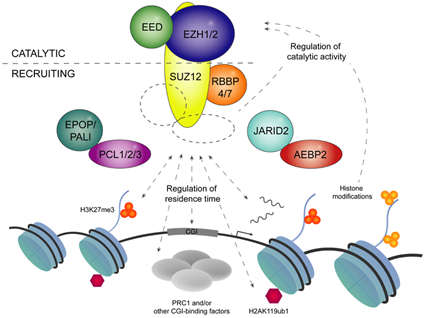
图2 PRC2组装募集和H3K27甲基化的分子机制[1]
1990年代,科学家发现EED通过识别组蛋白修饰调控PRC2的活性,从而维持基因沉默。2010年后,高通量测序技术揭示了EED在多种癌症中的突变,使其成为表观遗传药物开发的重要靶点。
1.2 EED 的结构与生物学功能
EED是一种重要的表观遗传调控因子,人类EED基因编码441个氨基酸,主要由7个WD40重复结构域组成(图3),形成典型的β-螺旋桨结构,其核心功能是结合H3K27me3并变构激活PRC2的甲基转移酶活性(依赖EZH2的SET结构域)。EED作为PRC2复合体的组装支架之一,能够识别组蛋白H3的甲基化标记(特别是H3K27me3),通过变构激活PRC2的甲基转移酶活性,参与染色质压缩和基因沉默。
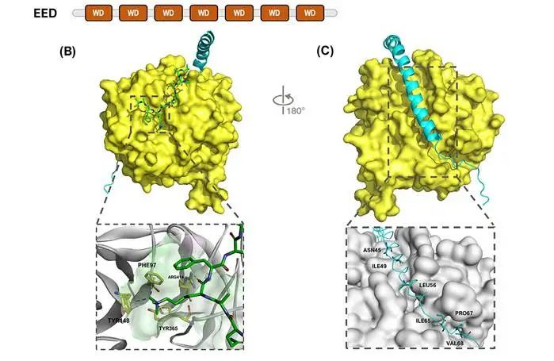
图3 EED基本结构示意图[2]
1.3 EED 与疾病的关系
PRC2复合体包括zeste同源物2增强子(EZH2)或zeste同源物1增强子(EZH1)、EED和zeste 12蛋白同源物抑制子(SUZ12)。EZH2作为组蛋白甲基转移酶,与EED和SUZ12相互作用,催化一个甲基从S-腺苷蛋氨酸(SAM)辅因子转移到赖氨酸的ε-氨基(图4)。EED稳定PRC2复合物,增强甲基转移酶活性,并通过H3K27三甲基化EED-EZH2相互作用的机制促进染色质上扩展。SUZ12与EZH2相互作用,EED稳定了PRC2的活性位点,为参与PRC2复合体的因子提供了一个对接平台。
PRC2亚基突变的过表达和激活,导致其在不同类型的癌症中既是致癌基因又是肿瘤发生的抑制基因。EZH2、EED和SUZ12在乳腺癌、结直肠癌和前列腺癌(PCa)中经常上调。EZH2和H3K27me3水平升高与细胞增殖加剧和化疗耐药性有关,导致生存率降低。EZH2催化结构域内Y641和A677残基的杂合体细胞突变与弥漫大b细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)有关。
SUZ12和EED维持PRC2复合物的稳定性和完整性,这对于EZH2调节H3K27me3抑制标记的功能至关重要。研究发现,EED或SUZ12表达升高以及EZH2水平升高与不良预后相关。抑制PRC2复合体抑制肿瘤生长,使其成为一个有希望的治疗靶点。成功靶向EED和EZH2可有效抑制PRC2的催化活性。
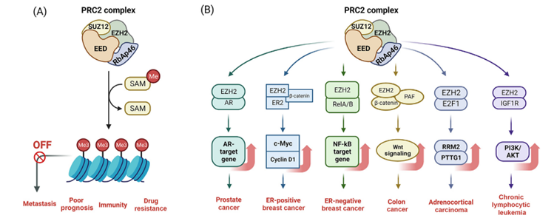
图4 EED在癌症中的作用机制[2]
1.4 EED药物研发现状
尽管小型PRC2抑制剂的临床开发取得了令人印象深刻的进展,一种EZH2抑制剂被批准用于癌症治疗,其他几种候选药物正在临床试验中,但目前的EZH2抑制剂仅限于治疗某些血液系统恶性肿瘤,并且已经获得耐药性。
靶向EED为抑制PRC2功能提供了一种有希望的新策略,并显示出克服EZH2抑制剂遇到的问题的潜力。目前针对EED的癌症治疗策略,包括变构抑制剂、蛋白蛋白相互作用(PPI)抑制剂和靶向蛋白水解嵌合体(PROTACs)(图5)。MAK683(诺华)是首个进入临床的EED小分子抑制剂,通过结合EED的H3K27me3口袋,破坏PRC2的活性,用于晚期淋巴瘤的临床试验(NCT02900651)。针对PRC2抑制剂的耐药性问题(如SWI/SNF复合物代偿激活)和联合治疗策略(如联合EZH2抑制剂或PD-1抗体)是研发重点。
非ATP竞争性抑制剂:不与激酶ATP 结合位点相互作用,只特异性地与激酶构象变化所暴露的“变构位点”相结合,因此表现出最大的选择性。目前临床使用的该类Src 激酶抑制剂只有Ponatinib,用于治疗慢性粒性白血病。
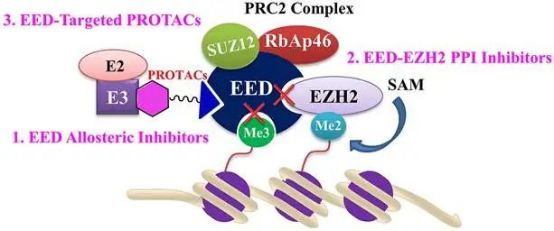
图5 针对EED靶点的药物开发策略[3]
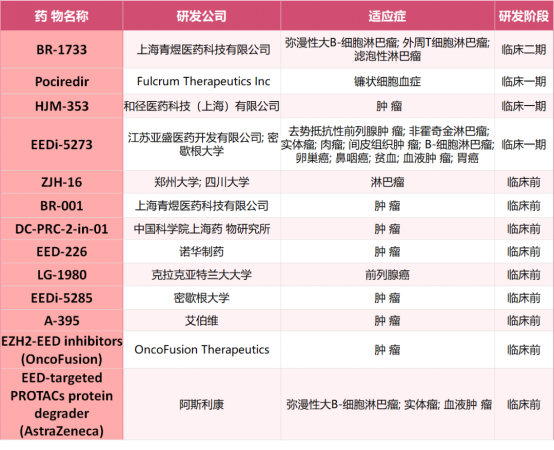
表1. EED 蛋白行业研发状况
EED 实验结果展示
青云瑞晶完成了EED和小分子共晶的结构解析,针对该靶点积累了丰富的蛋白表达纯化和抑制剂的共晶结构解析的经验。基于这些实验条件和库存蛋白,将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
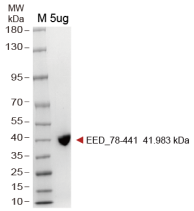
下述内容均以EED_78-441单晶结构为例。
▶ EED 表达纯化结果(周期:现货或者2周)
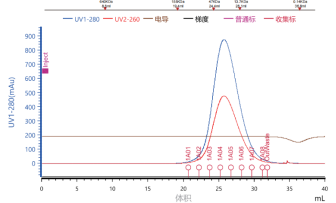
▶ EED结晶和结构解析(周期:1-2周)

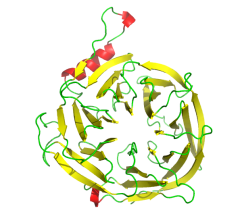
Resolution1.65Å
「青云瑞晶」提供专业的结构解析技术服务,自拥有单晶X射线衍射(XRD)、冷冻电镜单颗粒法(CryoEM-SPA)、MicroED 三种结构解析技术平台,根据蛋白质的不同性质,提供不同的解决方案,结合精良高端的实验设备、经验丰富的高学历科研团队,为您提供从蛋白表达开始的一站式结构解析服务,灵活多样化满足您的多种科研及工业界需求。
★ 参考文献
[1] Laugesen A, Højfeldt JW, Helin K. Molecular Mechanisms Directing PRC2 Recruitment and H3K27 Methylation. Mol Cell. 2019 Apr 4;74(1):8-18. doi: 10.1016/j.molcel.2019.03.011. PMID: 30951652; PMCID: PMC6452890.
[2] Bao Q, Kumar A, Wu D, Zhou J. Targeting EED as a key PRC2 complex mediator toward novel epigenetic therapeutics. Drug Discov Today. 2024 Jun;29(6):103986. doi: 10.1016/j.drudis.2024.103986. Epub 2024 Apr 18. PMID: 38642703; PMCID: PMC11416859.
[3] Zhao Y, Guan YY, Zhao F, Yu T, Zhang SJ, Zhang YZ, Duan YC, Zhou XL. Recent strategies targeting Embryonic Ectoderm Development (EED) for cancer therapy: Allosteric inhibitors, PPI inhibitors, and PROTACs. Eur J Med Chem. 2022 Mar 5;231:114144. doi: 10.1016/j.ejmech.2022.114144. Epub 2022 Jan 20. PMID: 35093670.




















