2025年9月,国家药品监督管理局药品审评中心发布了《化学药品创新药晶型研究技术指导原则(征求意见稿)》,这是我国首次针对创新药晶型研究发布的专项指导文件,标志着晶型研究在药品研发与审评中的重要性进一步提升。
该指导原则不仅凝聚了行业专家与企业的共识,也明确了药监部门在创新药晶型研究中的审评重点。对于正在或计划开展创新药研发的企业而言,理解并落实新规要求,已成为药物成功申报的关键一环。
作为一家专注于药物晶型研究的技术服务公司,青云瑞晶已完成300+ 晶型研究项目,服务超过50家生物医药公司,其中包括10家全球TOP20药企。本篇文章中,我们将从法规解读、研究流程梳理、典型发补案例三个维度,结合青云瑞晶的实践经验,为您深度解析新规要点,助力药企合规、高效地完成创新药晶型研究。
一、一图读懂:2025创新药晶型研究指导原则核心要点

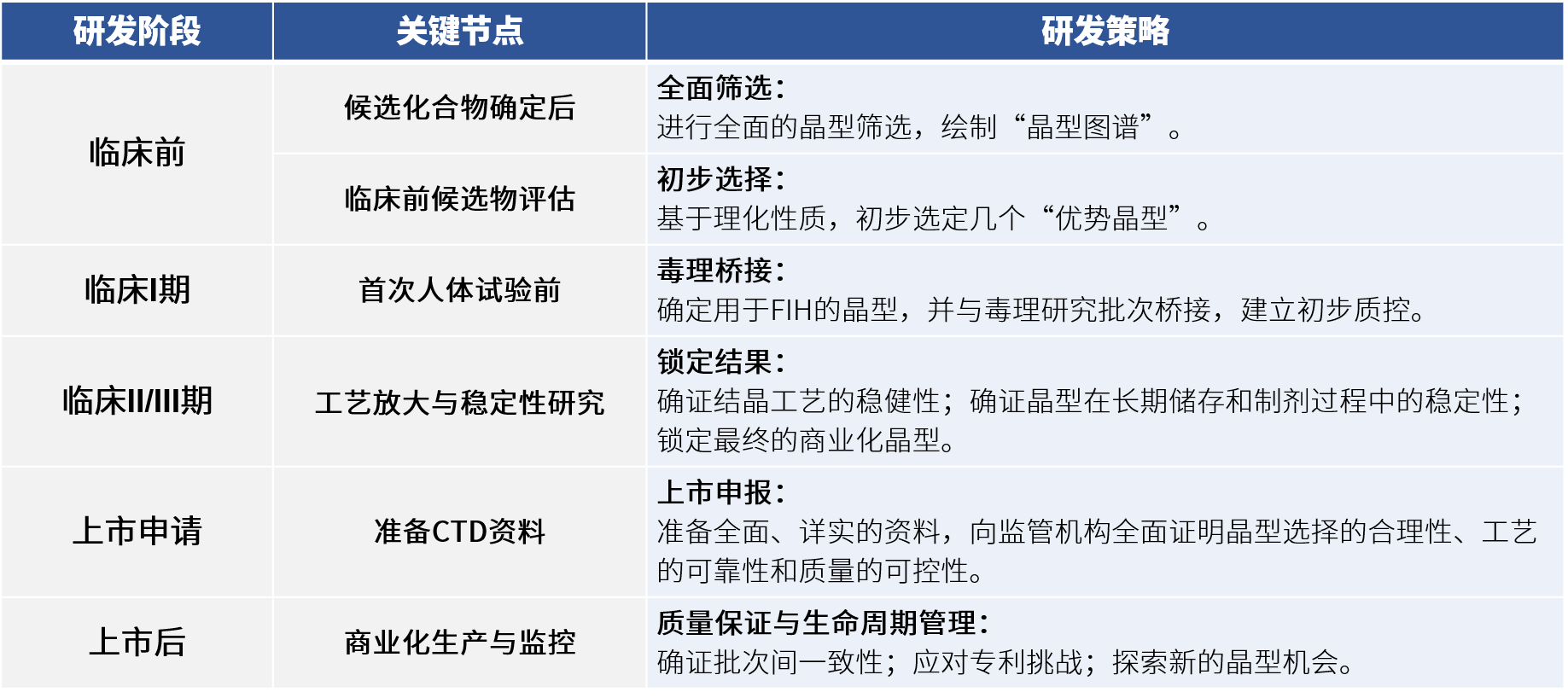
二、标准的晶型研究流程应如何展开?
三、创新药申报时常见的晶型相关发补问题?
1、制剂中的原料药晶型定量数据缺失
l 原因:
忽略生产药品时,生产工艺对原料药晶型产生的影响,递交上市资料时该部分研究缺失
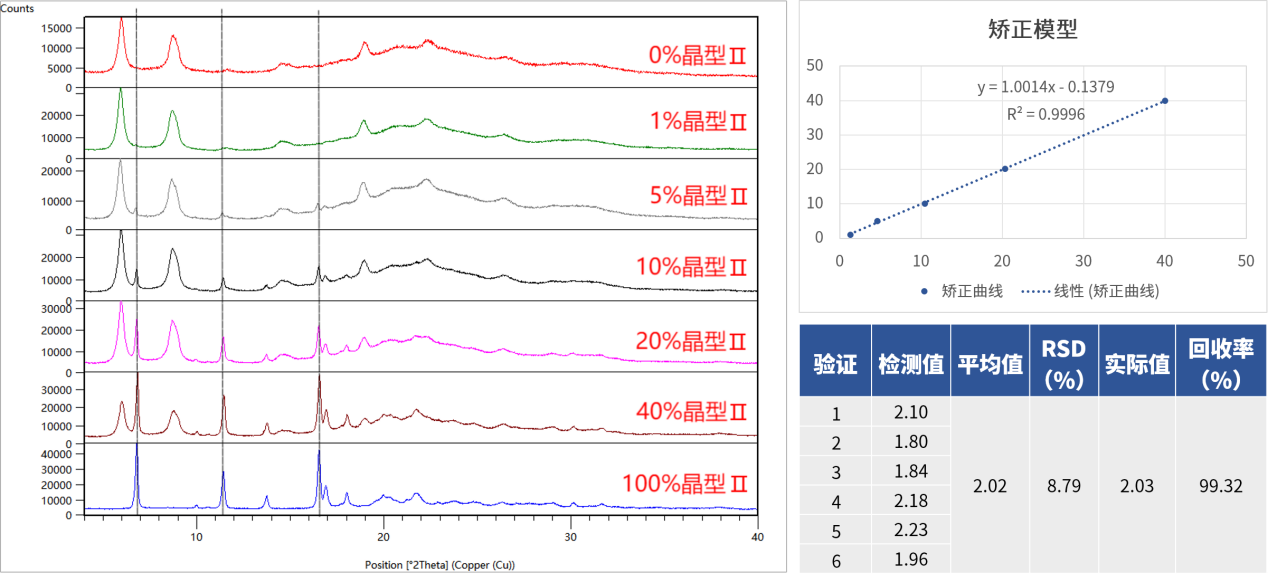
l 案例:某原料药中杂质晶型ⅡPXRD定量分析方法开发
本品存在多晶型现象,药用晶型Ⅰ与杂质晶型Ⅱ共存时存在明确混晶风险,会影响药品的生物利用度。
针对这个难题,我们通过优化制样与扫描参数,成功建立了基于特征峰的PXRD定量方法。通过配制0%~100%的梯度样品,我们绘制出线性优良的校正曲线(R² = 0.9996),并完成了全面方法学验证。该方法有效测定了低至1%的杂质晶型Ⅱ,RSD符合要求,最终成功助力企业完成该原料药的注册申报。
l 青云建议:
常规研究多依赖于定性的PXRD分析,但若工艺中存在晶型转化风险,仅凭定性结果往往难以精准评估杂质晶型的含量,从而为审评带来不确定性。因此,我们建议在药物开发中早期引入并持续完善晶型定量监控策略,可参考技术指导原则中推荐的PXRD定量分析方法,通过方法开发与验证,精准控制杂质晶型含量。这不仅能有效防范因晶型变化引起的生物利用度波动,还能有效规避审评阶段的发补风险,确保药品顺利获批与上市。
2、复杂API的分子结构确证
l 原因:
最终用于成药的API分子结构过于复杂,添加了许多修饰,导致很难培养适合做X射线衍射的单晶。迟迟没有得到准确的分子结构
l 案例:某共晶原研药物MicroED结构解析
该药是一款重磅新型共晶原研药物,API中两个分子对适应症起到协同作用的效果,市场前景极好。但由于共晶成分过于复杂,迟迟没有培养出合适做单晶衍射的晶体。
我司接到样品之后,直接从样品粉末中挑出合适的微晶颗粒,将最小尺寸只有几百纳米的晶体放在冷冻透射电镜中,使用MicroED进行数据收集和结构解析,最终获得了该共晶药物的结构,并协助该家企业完成药物上市申报工作。

l 青云建议:
新药小分子在上市申报中,结构确证数据是不可获取的一部分。常用的结构确证方式主要是X射线单晶衍射。但是许多药物小分子为了达到高活性、高选择性和良好的药代动力学性质结构都极其复杂,很难顺利培养出尺寸较大的晶体,这就增加了单晶解析的难度。面对结构复杂的新药时,可以尝试指导原则中新推荐的微晶电子衍射技术(MicroED),免去长时间的单晶培养过程,节省宝贵的研发时间和成本。
四、青云瑞晶:药物晶型研究专家
晶型研究贯穿药物全生命周期,从早期筛选到上市后监控,每一步都关乎药物的安全性、有效性与合规性。青云瑞晶凭借扎实的技术积累与丰富的项目经验,可为药企提供从晶型筛选、结构解析、工艺优化到申报支持的一站式解决方案。
如果您正在面临晶型研究的挑战,或希望提前布局新规下的研发策略,欢迎联系青云瑞晶,我们将为您提供专业、高效、可靠的晶型研究服务。




















