前言
锌指抗病毒蛋白(ZAP)是宿主识别病毒CpG二核苷酸的“哨兵”,但是它自身不具备酶活性,需要招募搭档执行 RNA 剪切。KHNYN被证实是ZAP限制多种病毒所必需的结合蛋白,其序列中包含一个推测属于PIN核酸酶超家族的结构域。然而,此前研究检测到该结构域极其微弱且无序列特异性的切割活性,这与KHNYN在抗病毒中不可或缺的地位形成显著矛盾。
因此,KHNYN究竟如何发挥其核酸酶功能、其活性是否受特定因子调控,以及其切割是否具有底物选择性,成为理解ZAP通路分子机制的核心未解问题。
近日,来自弗朗西斯·克里克研究所、伦敦国王学院、阿斯利康的研究人员发现,KHNYN的扩展PIN结构域并非以往认知中的弱活性核酸酶,而是一种严格依赖锰离子(Mn²⁺)的高效内切核糖核酸酶,并在ApC、ApA和UpA序列处表现出切割偏好。
通过解析KHNYN的晶体结构,发现其PIN结构域含有一个独特的N端结构臂,该结构域以锰离子依赖性方式特异性切割RNA。这一结构发现解释了其高效抗病毒活性的分子基础,解决了此前对其弱酶活性的矛盾认知。
这项研究除常规的生化表征外,通过晶体结构解析进行了较为深入的机制研究,高质量的结构生物学工作,为这项研究提供了最坚实的证据和最深度的机制洞察,从而使其达到了高水平期刊的发表门槛。
研究以“KHNYN is a manganese-dependent endoribonuclease required for ZAP-mediated antiviral restriction”为题发表在《Nucleic Acids Research》上。

研究内容
1. 严格依赖 Mn²⁺的内切核糖核酸酶
通过AlphaFold与多序列比对,发现KHNYN较ZC3H12家族多出一段N端延伸(V410–Q434)。构建核心PIN与扩展PIN表达体系,发现仅后者可溶且单分散,说明N端结构臂是蛋白稳定的关键。
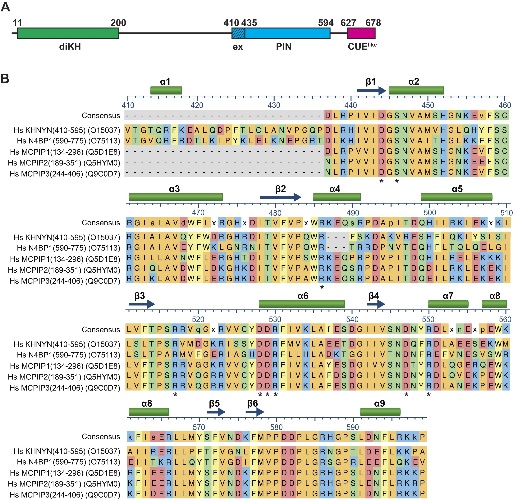
图1. ZAP和KHNYN中的结构域
NanoDSF分析显示,Mn²⁺能显著提高蛋白熔化温度(Tm),而Zn²⁺等则导致不稳定。
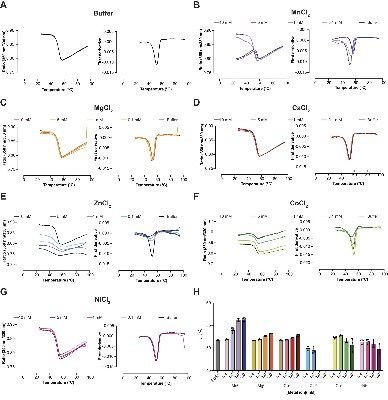
图2.KHNYN的稳定性
将活性中心的四天冬氨酸基序突变(D524A/D525A)后,酶活完全丧失。
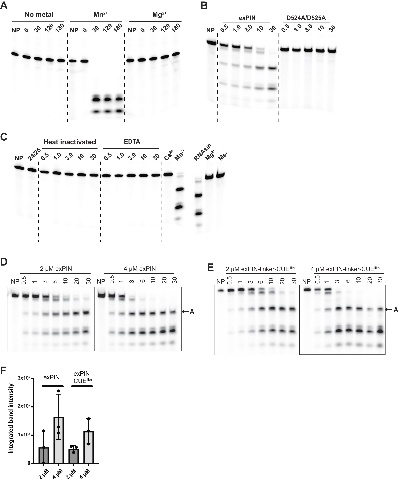
图3. KHNYN内切核酸酶活性
2. ex-PIN的作用机制与活性调控
ex-PIN仅切割单链RNA,不切割DNA,且在ApC、ApA和UpA处具有序列偏好性,对ZAP识别的CpG位点切割效率低。
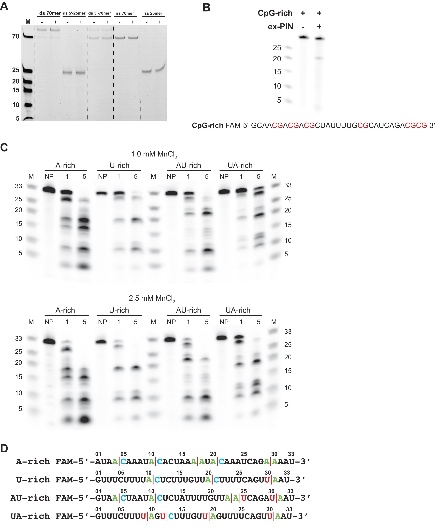
图4. KHNYN内切酶的特异性
生理浓度较高的Mg²⁺和Ca²⁺是ex-PIN的竞争性抑制剂,能在Mn²⁺存在时剂量依赖性地抑制切割活性,这解释了细胞如何避免酶活被非特异性激活。
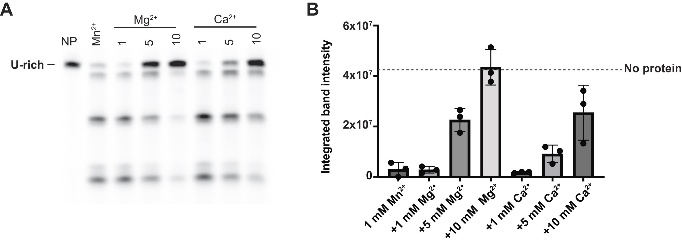
图5. KHNYN内切酶金属离子抑制作用
3. 结构基础:N端结构臂的关键作用
晶体结构揭示了一个先前未知的N端结构臂,其像“安全带”一样包裹核心结构域,通过大量相互作用稳定整个蛋白折叠。
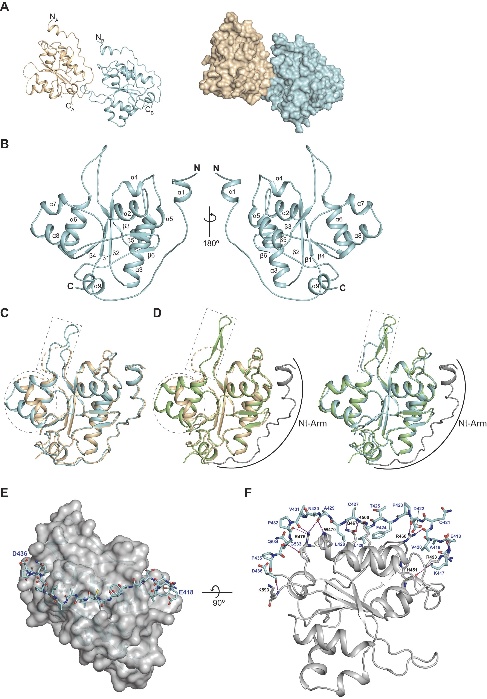
图6. KHNYN的ex-PIN结构域结构
活性中心的四天冬氨酸基序在无底物状态下已基本形成“预组织”构象,为快速响应Mn²⁺与底物结合做好准备。
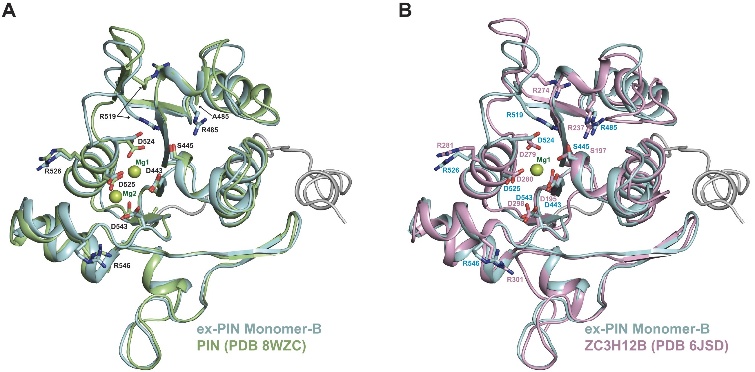
图7. KHNYN PIN结构域活性位点
4. 细胞水平的抗病毒功能验证
在细胞实验中,删除N端结构臂或催化双突变均使KHNYN完全丧失对CpG病毒的抑制能力。用同源蛋白N4BP1的PIN结构域替换KHNYN的ex-PIN,嵌合体仍保留抗病毒活性,表明该催化模块的功能在不同蛋白间是保守的。
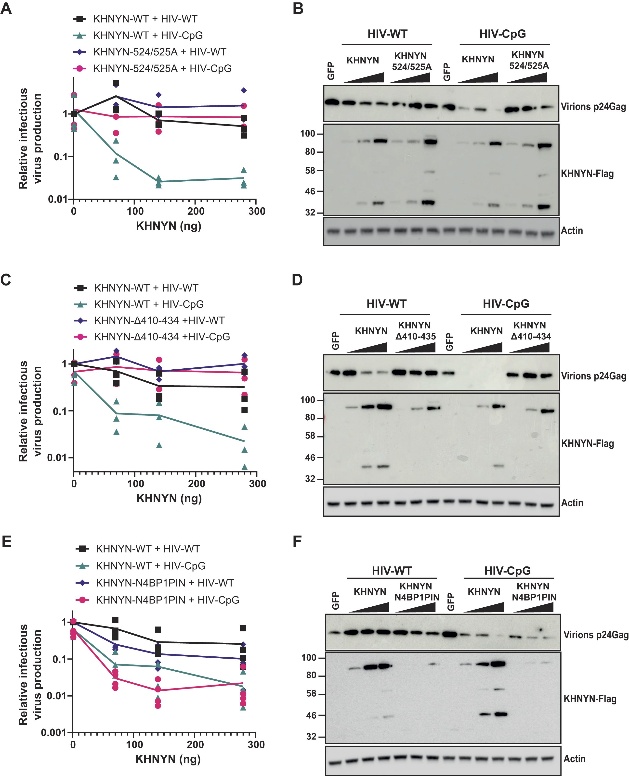
图8. Ex-PIN结构域突变体及其抗病毒活性
总结
本研究的核心发现是揭示了KHNYN并非一个作用微弱的配角,而是一个严格依赖Mn²⁺的高效RNA内切酶,对ApC、ApA和UpA具有切割偏好性。这一发现彻底更新了我们对ZAP-KHNYN抗病毒复合体降解病毒RNA的认知:ZAP负责识别并锚定富含CpG的RNA,而KHNYN则作为被Mn²⁺激活的“分子剪刀”,在邻近的特定序列位点进行精准切割。
通过原子分辨率晶体结构,研究首次可视化其独特的N端结构臂如何稳定催化核心,并从三维层面阐明其活性位点的金属结合特征,将抽象的生化机制转化为可观测的结构基础,推动了对其抗病毒功能的深入理解。




















