前言
CD73是一种关键酶,它能将单腺苷磷酸(AMP)催化为具有强免疫抑制作用的腺苷(ADO)。肿瘤微环境中高水平的腺苷会抑制T细胞的功能,促进肿瘤免疫逃逸。通过抑制 CD73 降低 ADO 水平或可逆转这种免疫抑制。
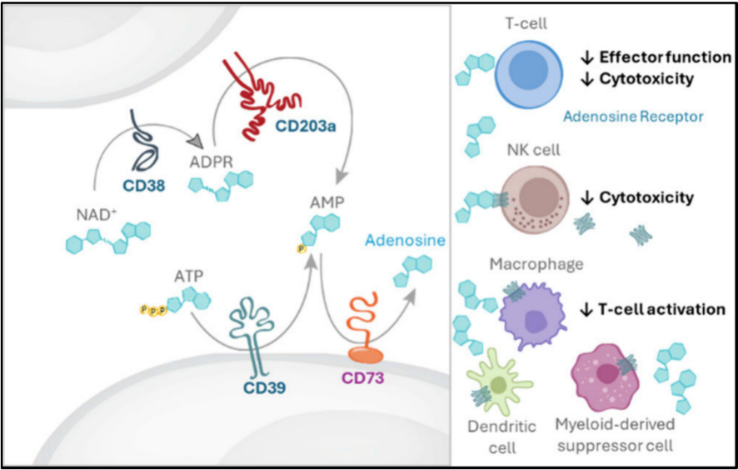
图1. CD73是免疫抑制腺苷产生所必需的。NAD+和ATP分解代谢通过CD73导致TME中免疫抑制ADO浓度增加。
目前已有多个CD73抑制剂进入临床,但口服小分子抑制剂仍较少见。已报道的高效小分子CD73抑制剂大多因分子极性强而存在口服吸收差的问题。此外肿瘤部位的AMP浓度通常很高,这也给抑制剂的效力带来了巨大的挑战。因此,开发出同时具备良好口服生物利用度、强大活性以及在高AMP环境中也能保持效力的CD73抑制剂,成了当务之急。
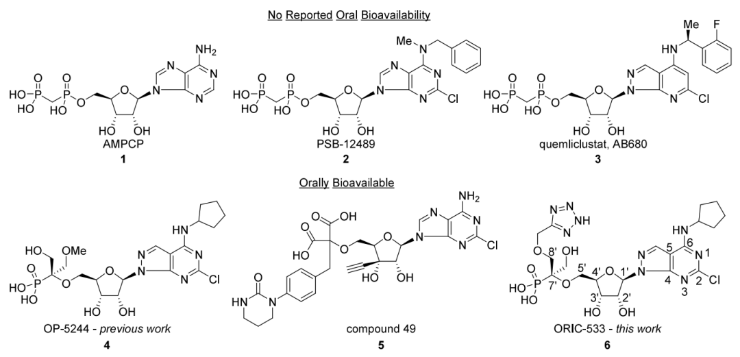
图2. CD73抑制剂。文献中报道的AMPCP (1)及其他基于腺苷结构的小分子CD73抑制剂(2)和(3)均不具备口服生物利用度;近期报道的化合物(4)和(5)虽展现一定口服生物利用度,但仍未完全达到开发候选药物所需的所有特性。
近日,ORIC Pharmaceuticals公司Richard T. Pomerantz等人报道了一种新型口服小分子CD73抑制剂ORIC-533的发现,该化合物具有良好的口服生物利用度、显著的抗肿瘤活性及优异的耐受性,目前该 CD73 抑制剂已进入多发性骨髓瘤患者的 Ⅰb 期临床试验。
该研究以“Discovery of ORIC-533, an Orally Bioavailable CD73 Inhibitor That Maintains Activity in High AMP Environments to Reverse Tumor Immunosuppression”为题发表在《Journal of Medicinal Chemistry》上。

研究内容
1. ORIC-533(化合物6)的发现
研究人员通过结构-活性关系(SAR)研究,从化合物4开始,逐步优化得到了化合物6。化合物6具有亚纳摩尔级别的生化活性和强效的细胞活性,能够在人类和小鼠肿瘤细胞系中发挥作用。
1)提高口服吸收:传统 CD73 抑制剂(如化合物7)含双膦酸基团,极性过高导致口服吸收差。研究团队通过观察化合物7与CD73的共晶结构(图3B, PDB 9R0D),去除其中一个膦酸基团,保留单膦酸结构,同时在 α 位引入羟甲基 / 甲氧基甲基取代基,降低分子极性,提升口服生物利用度(如化合物8首次实现啮齿类动物口服暴露)。
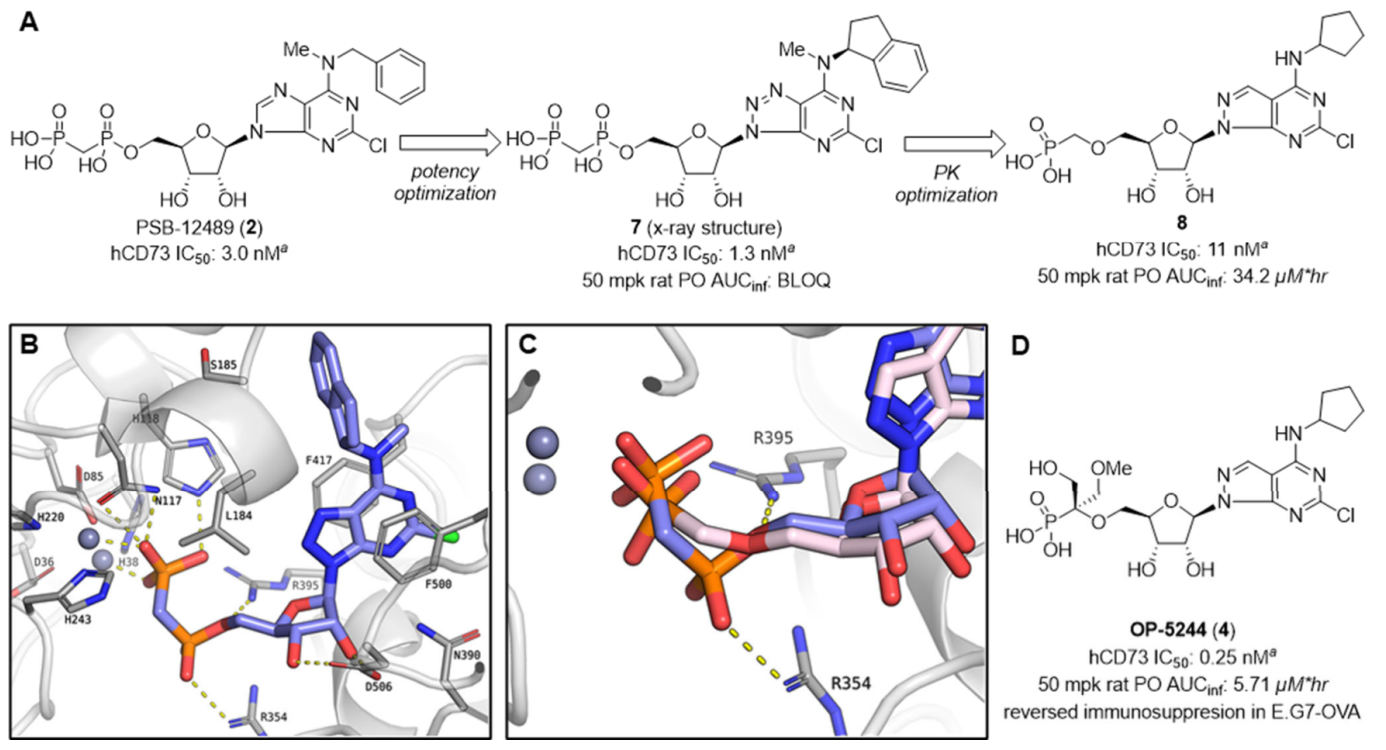
图3. ORIC-533 的结构优化历程与共晶结构基础
2)恢复和增强效力
单膦酸系列口服利用度提升,但效力下降。研究人员分析了化合物4(单膦酸先导物)与CD73的共晶结构(图4, PDB 7JV8),发现α-立体中心附近的S350和S445残基处于一个“空腔”中,可以被新的官能团靶向。
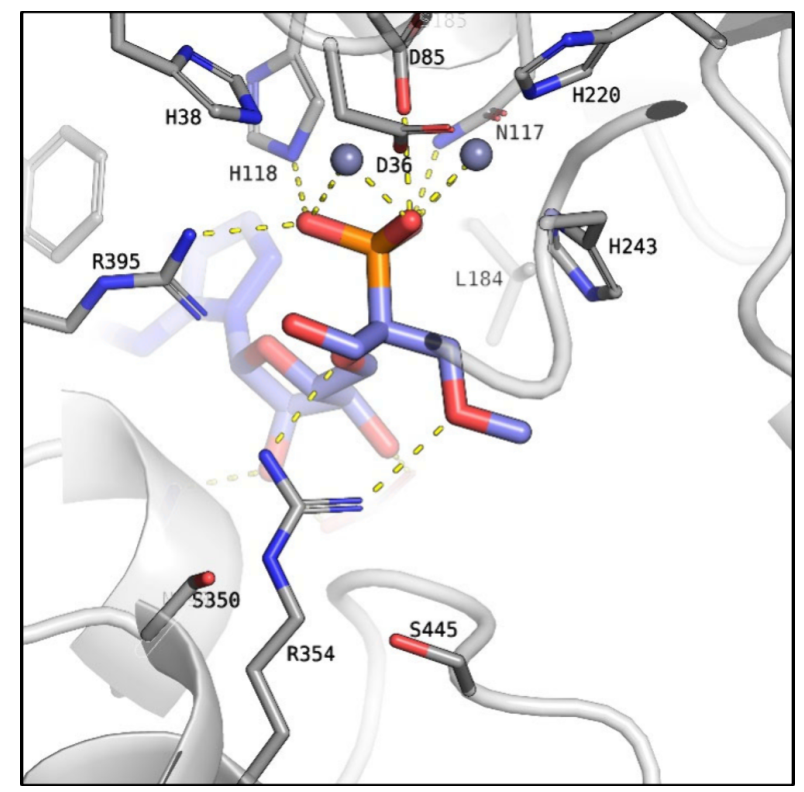
图4. CD73与化合物4的共晶结构
通过在α-立体中心引入一个甲基四唑基团(如化合物21),恢复并提升抑制活性。
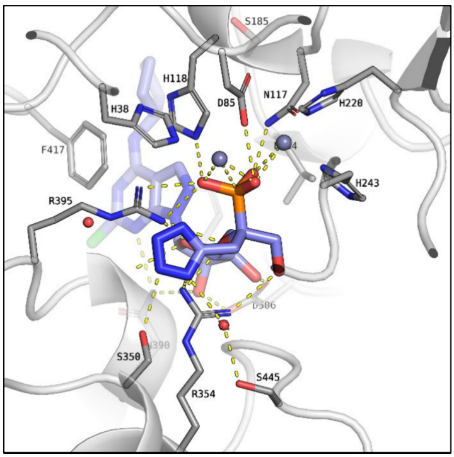
图5. CD73和化合物21的共晶结构(PDB 9R0G)
3)实现同类最优
化合物21对小鼠CD73的活性弱于对人CD73的活性,存在种属差异。通过延长四氮唑与膦酸基团间的连接链(引入羟甲基醚 linker),得到化合物 6(ORIC-533)。
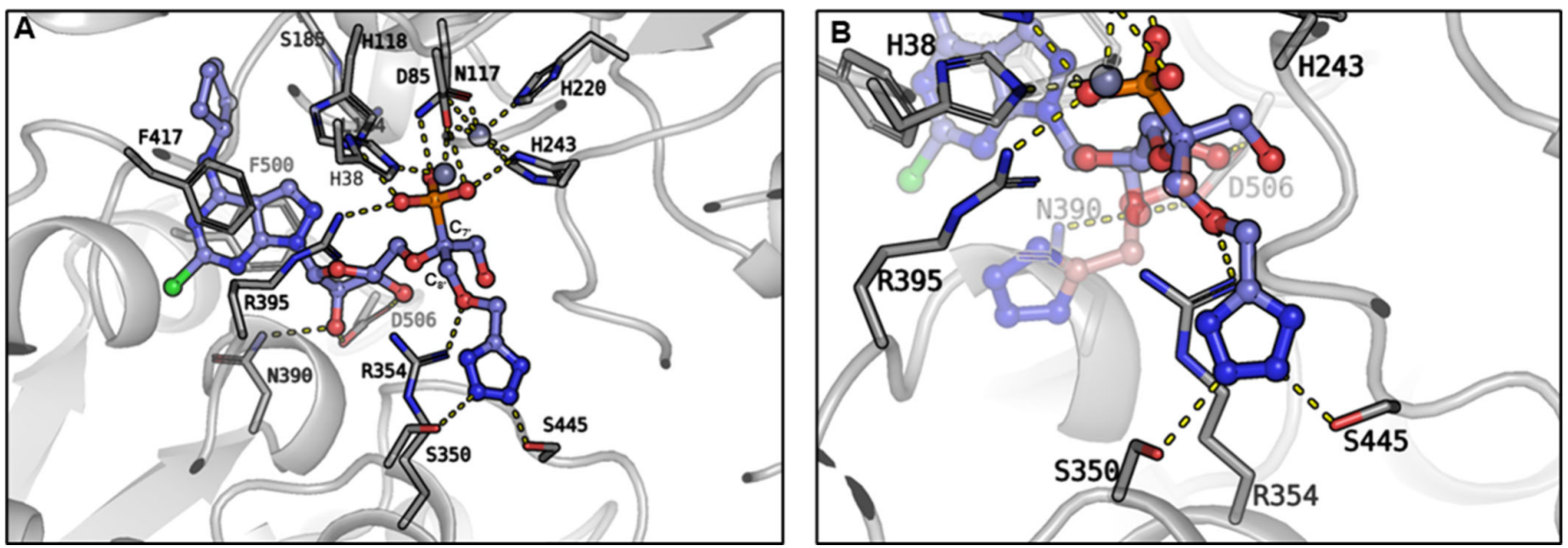
图8. ORIC-533(化合物 6)与 CD73 的高分辨率共晶结构
X射线晶体学结构为 ORIC-533 的 “同类最优” 特性提供最终结构证据:通过延长 linker 与新增氢键,既增强靶点结合亲和力,又适配高 AMP 环境下的活性需求。
2. 化合物6的体外活性
化合物6在低纳摩尔浓度下能够恢复T细胞的激活和细胞因子的产生,显示出强大的免疫调节活性。此外,化合物6在高AMP环境下仍能有效恢复T细胞增殖与细胞因子分泌。
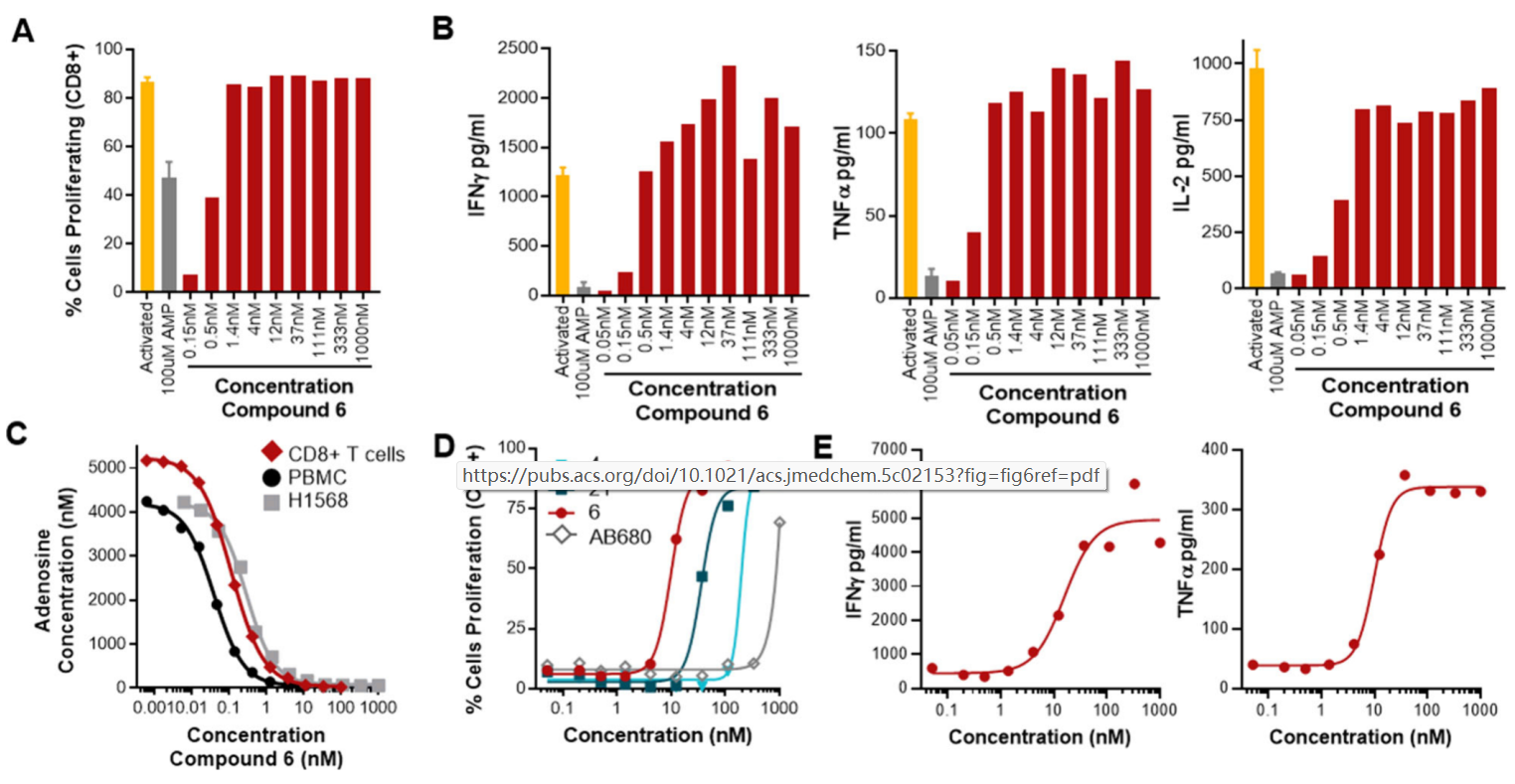
图6. 化合物6抑制腺苷的产生,即使在高AMP环境中也能恢复T细胞活化
3. 化合物6的体内活性
在小鼠的同种异体肿瘤模型中,口服给药的化合物6能够减少肿瘤中的ADO浓度,增加CD8+ T细胞浸润数量,并抑制肿瘤生长。
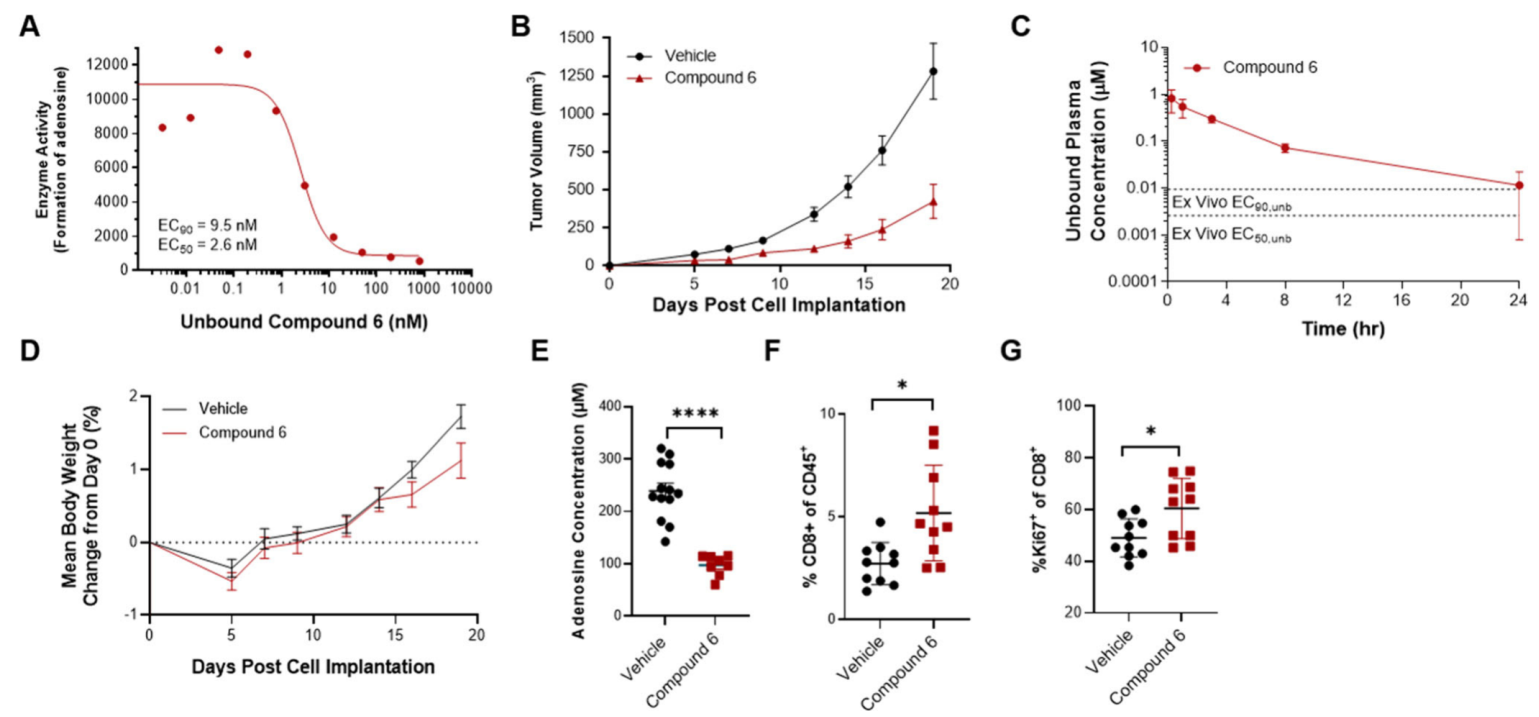
图7. 口服给药的化合物6在体内可抑制腺苷生成、减缓肿瘤生长并缓解肿瘤内免疫抑制
总结和展望
本研究通过结构导向药物设计,成功开发出口服生物利用型 CD73 抑制剂 ORIC-533,其亚纳摩尔级活性、高 AMP 环境适应性及口服特性使其具备 “同类最优” 潜力,该抑制剂已进入针对多发性骨髓瘤患者的1b期临床试验。
该研究通过解析CD73与多个化合物的共晶结构,提供了化合物与CD73相互作用的详细信息,指导了化合物的优化,提高了抑制活性。这些结构信息不仅有助于理解化合物的作用机制,还为开发更有效、更特异性的CD73抑制剂提供了重要的指导。




















