前言
在细胞中,有一类能在细胞膜内部直接切割蛋白质的酶,称为膜内蛋白酶(i-CLiPs)。它们参与调控许多关键的细胞过程,i-CLiPs根据催化机制可分为四类,其中,天冬氨酸蛋白酶家族包含早老素(PS)家族和信号肽肽酶(SPP)家族。
早老素家族作为γ-分泌酶的催化核心,与阿尔茨海默病密切相关,其结构已知。然而,其同源家族信号肽肽酶(SPP)是唯一尚未被结构表征的膜内蛋白酶家族。研究表明,SPP家族的代表SPPL2a的缺失会引发免疫缺陷,而其基因变异也与阿尔茨海默病风险相关。此外,一些旨在治疗阿尔茨海默病的γ-分泌酶抑制剂,也会“误伤”SPP家族成员,这可能会带来难以预料的副作用。
因此,解析信号肽肽酶家族,特别是SPPL2a的三维结构,对于理解其功能机制及其与早老素家族的选择性差异至关重要。
近日,西湖大学施一公与清华大学周瑞等相关研究人员首次解析了人源 SPPL2a 的高分辨率冷冻电镜结构,包括无配体状态和抑制剂L685,458结合状态。通过结构比较和功能分析,阐明了SPPL2a与早老素家族在结构、功能和抑制剂选择性上的差异。这不仅深化了我们对膜内蛋白酶工作机制的理解,也为未来针对神经退行性疾病和癌症等疾病的精准药物设计提供了关键线索。
该研究以“Structural insights into human signal peptide peptidase”为题,12月17日在线发表于《PNAS》上。

研究内容
1. 无配体状态下的SPPL2a结构特征
研究通过解析3.3 Å 的SPPL2a冷冻电镜结构图,发现其具有9个跨膜螺旋(TM1–TM9);
在无底物/抑制剂时,SPPL2a活性位点附近已存在一个反平行β-发夹结构。这与早老素1(PS1)不同,后者仅在底物/抑制剂结合时才形成类似结构,这可能解释了SPPL2a不依赖于其他辅助亚基的活性;
SPPL2a催化位点由TM6和TM7上的两个天冬氨酸残基(Asp351 和 Asp412)组成,间距约4.7 Å
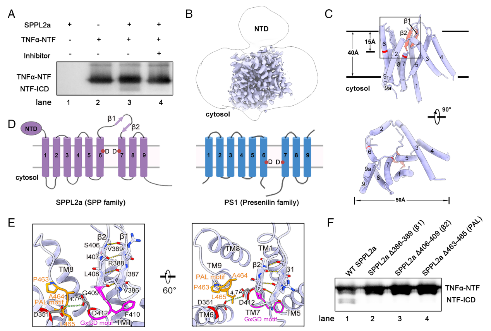
图1. 无配体状态下SPPL2a的结构
2. 抑制剂结合状态下 SPPL2a 的结构与构象变化
解析SPPL2a与抑制剂L685,458结合的3.6 Å结构显示,抑制剂分子嵌入两个催化天冬氨酸之间,通过氢键与疏水作用被精确识别。抑制剂结合诱导了显著构象重排:原本柔性的 TM2 向活性位点移动约 2.4 Å,同时 TM6 区域在胞外端形成一段新的短螺旋 TM6a,覆盖于抑制剂上方,使整体结构更为紧凑。
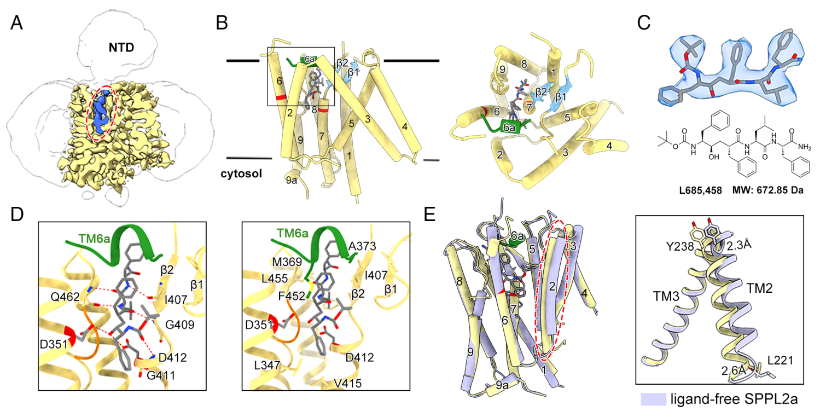
图2. 抑制剂结合引发SPPL2a的结构变化
3. SPPL2a 与 PS1 的结构对比分析

尽管存在差异,抑制剂L685,458在两者中结合模式高度相似,提示抑制剂诱导了局部构象的保守化。
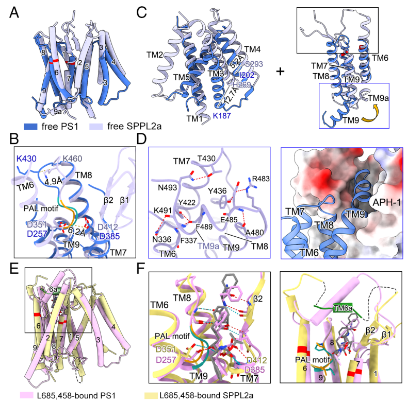
图3. SPPL2a和PS1的结构比较
4. 选择性抑制的结构基础
通过测试多种已知抑制剂,发现化合物E、BMS906024、LY411575等对γ-分泌酶的抑制效力远高于对SPPL2a。进一步解析化合物E与γ-分泌酶的复合物结构(2.9 Å)表明,该抑制剂两端基团与PS1的TM6a紧密作用。结构叠合显示,相同基团会与SPPL2a的TM6a发生空间冲突,从而在物理上阻碍其有效结合,从原子层面解释了选择性抑制的机制。
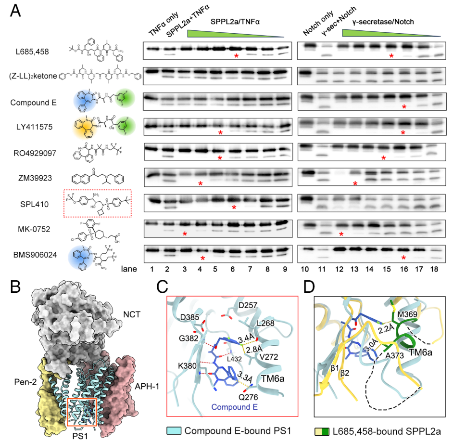
图4. 小分子抑制剂对SPPL2a和PS1的差异抑制作用
5. SPPL2a 与 PS1 的序列保守性分析
对SPP与早老素家族进行序列保守性映射发现:SPP家族保守残基主要集中在结构内部,用于维持催化核心稳定;而早老素家族保守残基广泛分布于分子表面,以适应其与APH 1、PEN 2等亚基的组装需求。
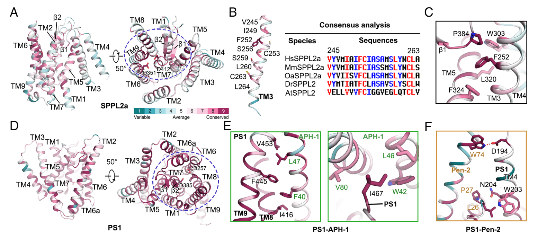
图5. SPPL2a 与 PS1 在结构保守性上呈现截然不同的分布模式
6. SPPL2a 的底物门控与切割分子机制
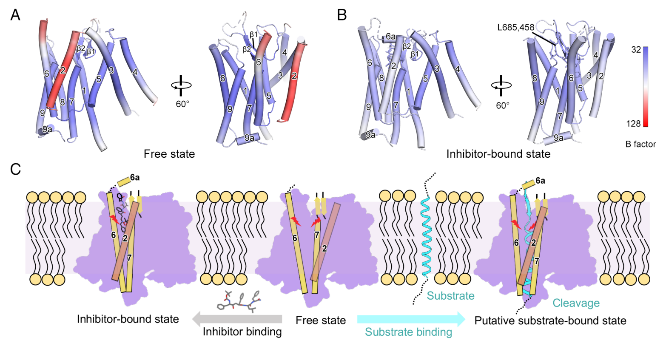
图6. SPPL2a 的底物门控与切割模型
总结
这项研究成功解析了人源SPPL2a的高分辨率结构,填补了膜内蛋白酶家族最后的结构空白。其核心发现在于揭示了SPP与早老素家族功能分化的结构基础。
研究发现,SPPL2a在无底物时,其活性位点附近已形成一个稳定的反平行β-发夹结构,使其能作为独立酶发挥作用;而早老素则需要组装成大复合物并在底物诱导下才形成类似结构。这种“预先准备”的状态是关键区别。研究进一步通过对比抑制剂结合结构,在原子层面解释了某些药物能选择性抑制早老素/γ-分泌酶,而不影响SPPL2a的分子机制,这源于抑制剂与两个酶活性口袋周围微小构象的匹配差异。
这项工作不仅完成了基础科学领域的一块重要拼图,更将为药物研发提供关键蓝图。基于这些精确的结构差异,未来有望设计出副作用更小、靶向性更高的新一代药物,用于治疗阿尔茨海默病、自身免疫性疾病等与这些蛋白酶密切相关的疾病。



















